Wpływ rodzaju wiązania chemicznego na właściwości substancji.
Ta praca została zweryfikowana przez naszego nauczyciela: 21.02.2024 o 16:54
Przedmiot: Matematyka
Dodane: 12.02.2024 o 18:39
Streszczenie:
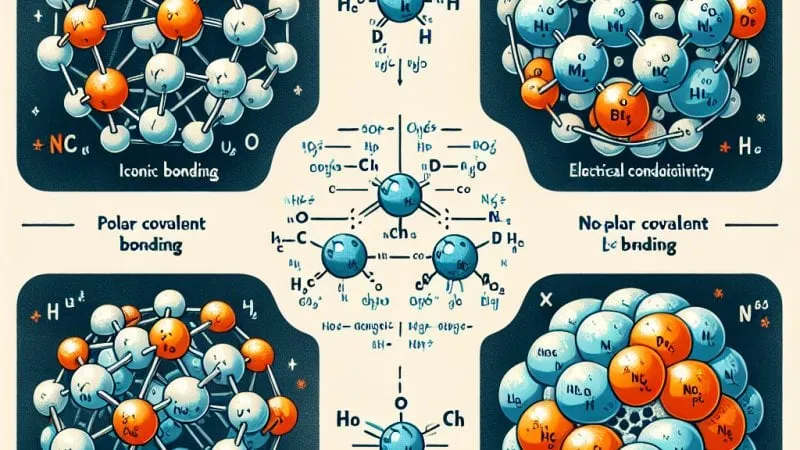
Praca omawia wpływ rodzaju wiązań chemicznych na właściwości substancji, takie jak stan skupienia, rodzaj kryształu, temperatura, rozpuszczalność i lotność. ?✅
Wiązania chemiczne odgrywają kluczową rolę w określaniu właściwości substancji, takich jak stan skupienia, rodzaj kryształu, temperatura, rozpuszczalność oraz lotność. Poniżej wyjaśniam, jak rodzaj wiązania chemicznego wpływa na te właściwości.
1. Stan skupienia: Substancje mogą występować w stanie stałym, ciekłym lub gazowym. Stan skupienia w dużej mierze zależy od siły wiązań między atomami lub cząsteczkami. - Wiązania jonowe i kowalencyjne sieciowe tworzą struktury krystaliczne, które zazwyczaj są trwałe i charakteryzują się stałym stanem skupienia przy temperaturze pokojowej. - Wiązania kowalencyjne polarne i niepolarne często występują w cząsteczkach, które mogą być ciekłe lub gazowe w temperaturze pokojowej, ze względu na słabsze oddziaływania między cząsteczkami (np. siły van der Waalsa). - Wiązania metaliczne tworzą ciała stałe, które mogą być miękkie i elastyczne (np. metale alkaliczne) albo twarde i kruchości (np. niektóre metale przejściowe).
2. Rodzaj kryształu: Krystaliczność materiału zależy od sposobu upakowania jego atomów, jonów lub cząsteczek, co jest bezpośrednio powiązane z typem wiązania. - Wiązania jonowe tworzą kryształy jonowe, w których dodatnio i ujemnie naładowane jony są ułożone w regularne trójwymiarowe sieci. - Wiązania kowalencyjne sieciowe tworzą bardzo twarde kryształy sieciowe, jak diament. - Wiązania metaliczne prowadzą do powstania kryształów metalicznych o charakterystycznej budowie, gdzie kationy metalu są rozmieszczone w sieci i otoczone "morzem" swobodnych elektronów.
3. Temperatura: Temperatura topnienia i wrzenia substancji jest związana z siłą wiązań między jej składnikami. - Wysokie temperatury topnienia i wrzenia są zazwyczaj obserwowane dla substancji z wiązaniami jonowymi lub kowalencyjnymi sieciowymi, które są trudne do zerwania. - Substancje z wiązaniami metalicznymi również wykazują często wysokie temperatury topnienia. - Niższe temperatury topnienia i wrzenia charakterystyczne są dla substancji związanych wiązaniami kowalencyjnymi (cząsteczkowymi), gdzie oddziaływania międzycząsteczkowe są stosunkowo słabe.
4. Rozpuszczalność: Rozpuszczalność substancji w danym rozpuszczalniku zależy głównie od podobieństwa rodzaju wiązań w substancji i w rozpuszczalniku ("podobne rozpuszcza podobne"). - Substancje jonowe i kowalencyjne polarne często dobrze rozpuszczają się w rozpuszczalnikach polarnych, jak woda, ponieważ występują między nimi oddziaływania jon-dipol. - Substancje z wiązaniami kowalencyjnymi niepolarnymi zazwyczaj dobrze rozpuszczają się w rozpuszczalnikach niepolarnych, jak np. benzyna.
5. Lotność: Lotność jest miarą, jak łatwo substancja przechodzi do stanu gazowego. - Niska lotność jest charakterystyczna dla substancji z mocnymi wiązaniami jonowymi lub kowalencyjnymi sieciowymi, gdyż potrzeba dużo energii, aby je przerwać. - Wysoka lotność jest cechą substancji z słabymi oddziaływaniami międzycząsteczkowymi, takimi jak siły van der Waalsa, ponieważ mniej energii potrzeba do przejścia substancji do fazy gazowej.
Oceń:
Zaloguj się aby ocenić pracę.
Zaloguj się