Budowa atomu i jego położenie w układzie okresowym
Ta praca została zweryfikowana przez naszego nauczyciela: 14.11.2023 o 16:11
Rodzaj zadania: Wypracowanie
Dodane: 12.11.2023 o 21:14
Streszczenie:
Budowa atomu oraz układ okresowy są kluczowe dla zrozumienia pierwiastków chemicznych. Jądro, elektrony i liczba atomowa determinują właściwości pierwiastków i ich reaktywność. Układ okresowy umożliwia klasyfikację pierwiastków według ich struktury elektronowej i właściwości chemicznych. ?
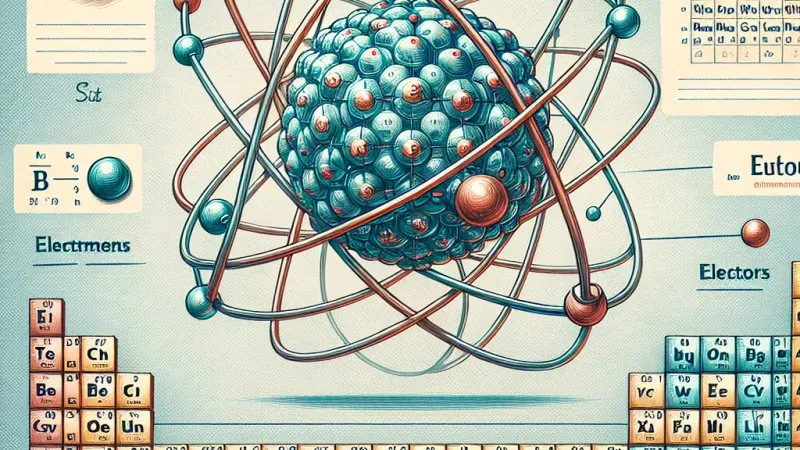
Budowa atomu i jego struktura są kluczowe dla zrozumienia położenia pierwiastka chemicznego w układzie okresowym. Atom składa się z jądra, w którym znajdują się protony i neutrony, oraz elektronowej obwódki, na której krążą elektrony. To połączenie różnych cząstek tworzy strukturę każdego pierwiastka chemicznego.
Jądro atomowe jest centralnym i najważniejszym elementem budowy atomu. Składa się z protonów, które mają ładunek dodatni, oraz neutronów, które są cząstkami obojętnymi pod względem ładunku. Liczba protonów w jądrze, zwana liczbą atomową, decyduje o rodzaju pierwiastka chemicznego. Na przykład, jeśli liczba atomowa wynosi 8, mamy do czynienia z tlenem, a gdy liczba atomowa wynosi 79, mamy do czynienia z złotem.
Elektrony krążą wokół jądra w powłokach elektronowych. Liczba elektronów zawsze jest równa liczbie protonów, co zapewnia neutralność atomu. Powłoki elektronowe są uporządkowane wokół jądra w pewnej kolejności. Najbliższa jądru powłoka może pomieścić maksymalnie 2 elektrony, kolejna powłoka 8 elektronów, a kolejne - coraz więcej. Ta struktura elektronowa ma duże znaczenie dla właściwości i reaktywności pierwiastków.
Jednym z kluczowych odkryć związanych z budową atomu był rozwój układu okresowego pierwiastków chemicznych. Układ okresowy to tabela, w której pierwiastki są uporządkowane według ich właściwości chemicznych i liczby atomowej. Pierwiastki są grupowane w okresy i kolumny na podstawie podobnej struktury elektronowej.
Położenie pierwiastka chemicznego w układzie okresowym jest związane z ilością elektronów na zewnętrznej powłoce elektronowej. Elektrony na zewnętrznej powłoce, zwanej powłoką walencyjną, decydują o właściwościach chemicznych pierwiastka. Na przykład pierwiastki z grupy 1, znane jako metale alkaliczne, mają tylko 1 elektron na zewnętrznej powłoce i dlatego są bardzo reaktywne chemicznie.
Układ okresowy umożliwia także określenie trendów w właściwościach pierwiastków wzdłuż i w pionie. Podobne pierwiastki znajdują się w tej samej kolumnie, zwanej grupą, a mają podobne właściwości chemiczne. Na przykład pierwiastki w grupie 17, zwane halogenami, są bardzo reaktywne i tworzą związki z metalem alkalicznym. Podobnie, pierwiastki w tym samym okresie, czyli w tym samym rzędzie, mają zwiększającą się liczbę atomową i powłok elektronowych.
Wniosek, zrozumienie budowy atomu i jego struktury jest kluczowe dla zrozumienia położenia pierwiastka chemicznego w układzie okresowym. Jądro atomowe, powłoki elektronowe i liczba atomowa decydują o rodzaju pierwiastka. Układ okresowy natomiast pozwala na grupowanie pierwiastków według ich właściwości chemicznych i elektronowej struktury, co umożliwia lepsze zrozumienie ich reaktywności i zachowań chemicznych.
Oceń:
Zaloguj się aby ocenić pracę.
Zaloguj się