Budowa atomu
Ta praca została zweryfikowana przez naszego nauczyciela: 26.10.2024 o 20:48
Rodzaj zadania: Wypracowanie
Dodane: 24.10.2024 o 20:57
Streszczenie:
Atom to podstawowa jednostka materii z jądrem i elektronami. Zrozumienie atomów wpływa na chemię, fizykę i technologie. ?✨
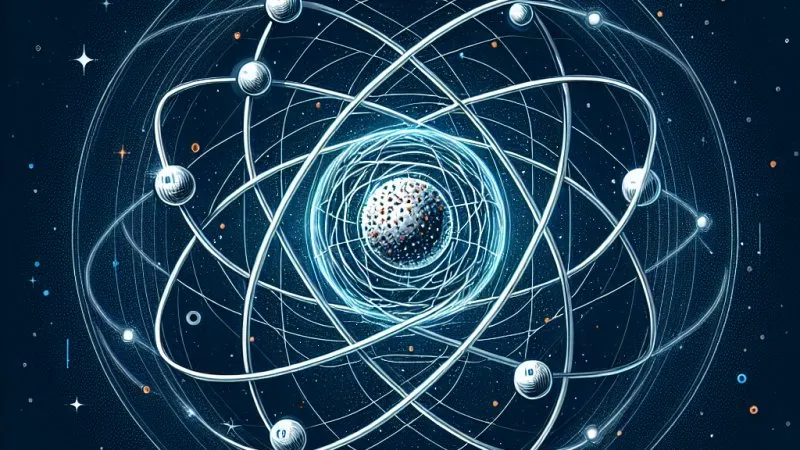
Budowa atomu to fascynujący temat, który jest fundamentem naszej wiedzy o świecie na poziomie mikroskopowym. Atom jest podstawową jednostką materii, a jego struktura składa się z jądra oraz otaczających go elektronów. To, jak są one rozmieszczone i jakie mają właściwości, decyduje o właściwościach chemicznych i fizycznych wszystkich substancji.
Historia odkrywania budowy atomu jest pełna pasjonujących momentów. Zaczęło się od starożytnych filozofów takich jak Demokryt, który już w IV wieku p.n.e. spekulował, że materia składa się z małych, niepodzielnych cząstek zwanych atomami. Jednak brakowało wtedy dowodów empirycznych na poparcie tej tezy.
Dopiero na przełomie XIX i XX wieku, dzięki rozwinięciu nowoczesnej nauki, zaczęły się pojawiać modele opisujące atom w bardziej szczegółowy sposób. Jednym z najwcześniejszych był model Thomsona, który opisywał atom jako kuleczkę naładowaną dodatnio z zatopionymi w niej elektronami, znany jako "model pudingu". Następnie, w 1909 roku, Ernest Rutherford przeprowadził słynny eksperyment ze złotą folią, który doprowadził do odkrycia jadra atomowego. Rutherford zauważył, że większość cząstek alfa przechodzi przez folię bezproblemowo, ale niektóre odbijają się pod dużymi kątami. Te obserwacje zasugerowały, że atom składa się z gęstego jądra otoczonego dużą przestrzenią, gdzie poruszają się elektrony. To był kamień milowy w zrozumieniu budowy atomu.
Następnym krokiem było wyjaśnienie, w jaki sposób elektrony są rozmieszczone wokół jądra. Niels Bohr w 1913 roku przedstawił model atomu wodoru oparty na mechanice kwantowej. Zgodnie z modelem Bohra, elektrony krążą wokół jądra po określonych orbitach, a przeskok elektronu między orbitami jest związany z emisją lub absorpcją energii w postaci kwantów światła. Choć model Bohra dobrze opisywał atom wodoru, nie był w stanie w pełni oddać złożoności innych pierwiastków.
Dzisiejsze rozumienie struktury atomu jest oparte na mechanice kwantowej, w szczególności na modelu atomu Schrödingera. Zamiast traktować elektrony jako cząstki krążące po sztywnych orbitach, model kwantowy opisuje je jako chmury prawdopodobieństwa rozmieszczone wokół jądra w postaci orbitali. Pomimo że te orbity nie są fizycznymi ścieżkami, pozwalają one na przewidywanie, gdzie można znaleźć elektron z największym prawdopodobieństwem.
Jądro atomowe składa się z protonów i neutronów, zwanych nukleonami. Protony są naładowane dodatnio, natomiast neutrony są obojętne elektrycznie. Liczba protonów określa, do którego pierwiastka należy atom, co jest znane jako liczba atomowa. Neutrony pełnią istotną rolę w stabilizacji jądra, ponieważ działają jako "klej", pomagając zneutralizować siły odpychające między protonami.
Poza jądrem znajdują się elektrony, które są ujemnie naładowane. Ich liczba w stanie obojętnym atomu jest równa liczbie protonów, co zapewnia równoważność ładunków. Rozmieszczenie elektronów w powłokach elektronowych wpływa na właściwości chemiczne pierwiastków, a szczególne znaczenie mają elektrony walencyjne, które uczestniczą w tworzeniu wiązań chemicznych.
Istnieje kilka typów wiązań chemicznych, które zależą od układu elektronów. Najważniejsze z nich to wiązania kowalencyjne, jonowe i metaliczne. W wiązaniach kowalencyjnych dwa atomy dzielą między sobą pary elektronów, co zwykle zachodzi między niemetalami. Wiązania jonowe polegają na całkowitym przeniesieniu elektronów z jednego atomu do drugiego, prowadząc do powstania jonów - kationów i anionów, które przyciągają się nawzajem. Z kolei wiązania metaliczne charakteryzują się "morzem elektronów", które są wspólne dla całego metalu, co wyjaśnia jego przewodnictwo elektryczne i inne właściwości charakterystyczne dla tej grupy pierwiastków.
Na koniec warto zaznaczyć, że struktura atomowa jest również kluczowa dla zrozumienia reakcji jądrowych oraz zjawisk takich jak promieniotwórczość. Procesy te, w których dochodzi do przemiany jąder atomowych, mają ogromne znaczenie nie tylko w nauce, ale i w wielu zastosowaniach praktycznych, od medycyny, przez energetykę, po zastosowania wojskowe.
Podsumowując, badanie budowy atomu pozwala zrozumieć podstawowe zasady rządzące materią i energią. Dzięki postępom w tej dziedzinie nauki, ludzkość zyskała możliwość nie tylko obserwacji, ale i manipulacji materią na poziomie atomowym, co otwiera przed nami ogromne możliwości w dziedzinie technologii i nauki.
Ocena nauczyciela:
Ta praca została zweryfikowana przez naszego nauczyciela: 26.10.2024 o 20:48
O nauczycielu: Nauczyciel - Agata K.
Od 9 lat pracuję w liceum ogólnokształcącym i wspieram uczniów w budowaniu pewności w pisaniu. Wspieram w przygotowaniu do ważnych egzaminów, rozwijając myślenie krytyczne oraz umiejętność jasnego formułowania tez. Na lekcjach dbam o życzliwą atmosferę i konkretne wskazówki, dzięki którym praca z tekstem staje się praktycznym narzędziem, a nie tylko zbiorem reguł. Moi uczniowie doceniają spokojne tempo pracy, uporządkowane notatki i strategie, które przekładają się na lepsze wyniki.
Świetne wypracowanie! Doskonale opisujesz budowę atomu, od jego historycznych modeli po nowoczesne teorie.
Komentarze naszych użytkowników:
Oceń:
Zaloguj się aby ocenić pracę.
Zaloguj się